Ligações iônicas – O que são? Para que servem? Exemplos e Exercícios
Os átomos estão constantemente em busca de estabilidade, para isso estabelecem ligações entre si. Uma destas possibilidades é a ligação iônica.
Neste tipo de ligação, tem-se a transferência de elétrons dentre os participantes, com consequente ligação eletrostática entre eles.
A seguir, saiba tudo a respeito do assunto, bem como teste os seus conhecimentos nos exercícios, ao final, só aqui no Gestão Educacional!
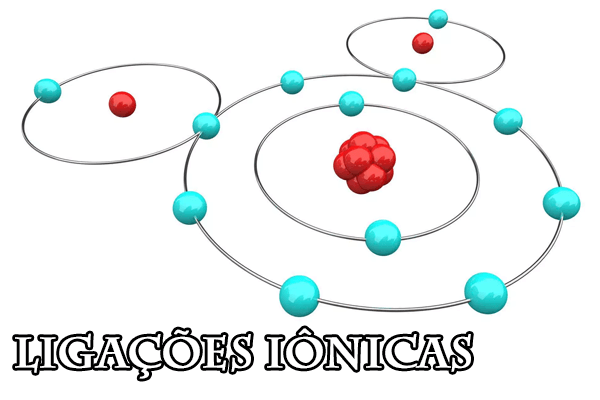
O que são ligações iônicas?
A ligação iônica ocorre entre dois elementos distintos, que são:
- Metal: elemento que tem tendência a doar um elétron, e, consequentemente, tornar-se um cátion (com carga positiva);
- Não metal: pode ser ametal, semi-metal ou hidrogênio, visto que estes têm a propriedade de doar elétrons e tornarem-se ânions (com carga negativa).
Como resultado, tem-se uma ligação eletrostática unindo os átomos e resultando em estabilidade.
Função das ligações iônicas
Por falar em estabilidade, este é o principal motivo de ocorrerem as ligações dentre os átomos. A Teoria do Octeto foi proposta no início do século passado, por Kossel e Lewis, determinando que os átomos buscam assemelhar-se à configuração dos gases nobres.
Mas, por que os gases nobres? Os pertencentes da família 8A possuem 8 elétrons na última camada (exceto o Hélio, que tem 2), sendo estáveis.
Então, os demais elementos buscariam doar ou receber elétrons em sua última camada de valência, com o objetivo de preenchê-la, e, assim, conseguir estabilidade.
Composição
Para entender melhor como as ligações iônicas ocorrem, vamos retomar os conceitos de cátion e anion.
Primeiramente, devemos considerar que a ligação só irá ocorrer se houver equilíbrio entre as cargas, e se cada átomo tiver 8 elétrons na camada de valência.
Tomando como exemplo o cloreto de sódio (sal de cozinha), expresso pela fórmula NaCl, temos que:
- O sódio (Na) pertence à família 1A, portanto, tem um elétron na sua camada de valência. Para adquirir estabilidade, é mais fácil que ele perca um elétron ao invés de receber 7. Concorda? Tal propriedade é chamada de eletropositividade (tendência a doar elétrons);
- O cloro (Cl) pertence à família 7A, portanto, tem 7 elétrons na camada de valência. Seguindo a teoria do octeto, para que ele adquira estabilidade, precisa apenas receber um elétron. Tal propriedade é chamada de
Sendo assim, há uma relação de 1:1, na qual ocorre a transferência de elétrons. Como resultado, tem-se a união de um cátion (Na+) com um ânion (Cl–).

Características
As ligações iônicas devem ser facilmente reconhecidas pelas características que possuem. Dentre elas, destacam-se:
- Altos pontos de fusão e ebulição;
- Compostos sólidos e cristalinos;
- Incapazes de conduzir corrente elétrica, quando puros no estado sólido, apenas quando fundidos ou em solução aquosa são capazes de tal.
Exemplos
Os principais exemplos de ligações iônicas, muito utilizadas no dia a dia, são:
1) Sal de cozinha, mencionado anteriormente, formado por NaCl;
2) Cloreto de magnésio, MgCl2, utilizado como suplemento mineral;
3) Óxido de alumínio, expresso por Al2O3.
Agora que você já sabe um pouco mais a respeito das ligações iônicas, que tal testar os seus conhecimentos nos exercícios que preparamos para você? Basta rolar até o final da página e se divertir! Ah, e não deixe de compartilhar com os seus amigos, desafiando eles também.








Deixe seu comentário