Camada de Valência – definição, como determinar e exemplos.
Entenda o que é Camada de Valência, aprenda a determiná-la e veja um exemplo prático de como fazer isso! Só aqui no Gestão Educacional!
A distribuição dos elétrons em um átomo é orientada através dos números quânticos, os quais determinam a camada (nível), a subcamada (subnível) e o orbital em que um elétron pode se encontrar.
A camada de valência é a camada (nível) mais externa em um átomo, é o nível energético mais distante do núcleo atômico. Os elétrons que se encontram na camada de valência serão os que participarão das ligações químicas com outros átomos para a formação de moléculas.
Divisão da eletrosfera
A eletrosfera de um átomo é a região ao redor do núcleo atômico que o elétron pode ocupar. Essa região se divide em 7 camadas (níveis) de energia, sendo eles respectivamente representados por: K, L, M, N, O, P, Q, ou pelos números: 1, 2, 3, 4, 5, 6, 7. O número de camada é denominado como número quântico principal (n).
Cada camada (nível) é subdividida em subcamadas (subníveis): s, p, d, f. O número máximo que cada subnível pode comportar de elétrons é, respectivamente: 2, 6, 10, 14.
Para realizar a distribuição (configuração) eletrônica de um átomo, os subníveis são preenchidos de forma crescente de energia. Segundo a teoria de Linus Pauling, a energia dos subníveis cresce na seguinte ordem: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p… Conforme orienta o diagrama de distribuição eletrônica de Linus Pauling.
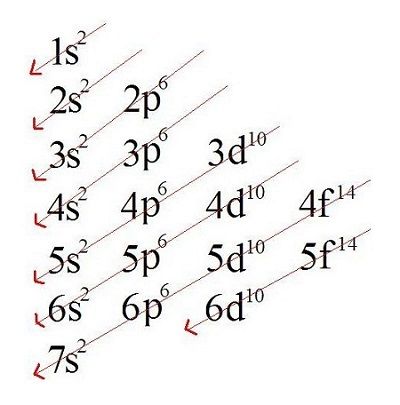
Como determinar a camada de valência de um átomo?
Existem duas formas para determinar a camada de valência de um átomo, pela distribuição eletrônica ou analisando a tabela periódica.
- 1ª maneira: é necessário realizar a distribuição eletrônica dos elétrons do átomo em estado fundamental, ou seja, estável, de forma crescente de energia, seguindo o diagrama de distribuição eletrônica estabelecida por Linus Pauling.
- 2ª maneira: determinando o período em que o elemento desejado se encontra na tabela periódica.
Exemplo: Fósforo (P): Z = 15
1. Pela distribuição eletrônica temos: 1s2, 2s2, 2p6, 3s2, 3p3. A última camada (nível) preenchida por elétrons é a camada (nível) 3, que equivale ao nível M, logo a camada de valência do fósforo em estado fundamental é a M, com 5 elétrons de valência.
2. Analisando a tabela periódica, esta possui sete períodos (linhas), os períodos equivalem ao número de níveis do diagrama de Linus Pauling. O elemento fósforo (P) ocupa a terceira linha da tabela periódica, ou seja, o terceiro período, tendo, portanto, a camada (nível) de valência = 3.
Referências
NUNES, M. Distribuição dos Elétrons. IFF Santa Catarina, Campus Lages, 2013.
BROWN, T. L.; LEMAY, E.; BURSTEN, B. E. Química: a ciência central. 9ª ed. São Paulo: Pearson Education, 2005.
FEITOSA, E. M. A.; BARBOSA, F. G.; FORTE, C. M. S. Química: química geral I. 3ª ed. Fortaleza-Ceará: Ed UECE, 2016.








Deixe seu comentário