Propriedades coligativas – O que são? Para que servem? Tipos e exemplos
Dentro do currículo do Ensino Médio, a química ainda é considerada um dos componentes mais difíceis para os alunos. Embora não tenha grande popularidade, essa disciplina é fundamental para o cotidiano, principalmente quando o assunto aborda as propriedades das substâncias e dos materiais.
É por isso que o entendimento das propriedades coligativas se faz necessário, afinal engloba as propriedades físicas das soluções. Conheça mais o que são essas propriedades e quais os seus tipos, aqui no Gestão Educacional!
O que são as propriedades coligativas?
Propriedades coligativas se referem às propriedades das soluções que dependem da quantidade de partículas dispersas, independentemente da natureza de tais partículas.
Ou seja, as propriedades coligativas envolvem o estudo das propriedades físicas das soluções, entretanto precisamente de um solvente em presença de um soluto.
Para entender melhor, é necessário definir:
- Solução – denomina toda mistura homogênea em que uma substância (seja em estado sólido, líquido ou gasoso) é dissolvida em um líquido;
- Solvente – é o componente – o líquido – de uma solução que dissolve um soluto;
- Soluto – é o componente de uma solução que é dissolvido por um solvente.
A presença de um ou mais solutos em soluções pode alterar certas propriedades delas, o que são as chamadas coligativas.
Embora pareça algo totalmente complicado e fora do universo de uso para um estudante, as propriedades coligativas são bastante usadas nos processos industriais e, dependendo, em algumas situações do dia a dia.
De toda forma, resumidamente falando, elas são as propriedades que surgem quando há a adição de um soluto não volátil a um solvente. São caracterizadas por depender somente da concentração da solução, isto é, quanto maior a concentração, maior o efeito da propriedade.
Além de entender que a presença do soluto afeta as propriedades físicas do solvente, as propriedades coligativas que possuem maior importância são:
- Abaixamento ou diminuição da pressão máxima de vapor do solvente;
- Aumento ou elevação da temperatura de ebulição do solvente;
- Abaixamento ou diminuição da temperatura de congelamento do solvente;
- Pressão osmótica.
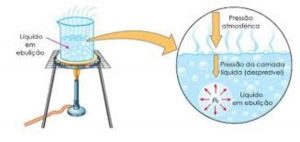
A pressão máxima de vapor condiz com a pressão do equilíbrio entre duas fases – a líquida e a de vapor – medidas a 20 °C. Assim, a pressão de vapor é variável conforme a temperatura:
- Ebulição – quando a pressão máxima de vapor é equivalente à pressão atmosférica a uma certa temperatura, ou seja, o líquido ferve. A adição de solutos poderá alterar essa temperatura;
- Congelamento – temperatura em que o estado líquido passa para o estado sólido.
Agora, é fundamental entender os tipos de propriedades coligativas conforme as descrições acima.
Tipos de propriedades coligativas
 Os efeitos coligativos estão relacionados aos fenômenos que acontecem com os solutos e os solventes de uma determinada solução. Por isso, a classificação dos tipos de propriedades coligativas deve ser explicada com mais detalhes:
Os efeitos coligativos estão relacionados aos fenômenos que acontecem com os solutos e os solventes de uma determinada solução. Por isso, a classificação dos tipos de propriedades coligativas deve ser explicada com mais detalhes:
- Tonoscopia ou tonometria (abaixamento ou diminuição da pressão máxima de vapor do solvente):
Efeito que ocorre por meio da dissolução de um soluto não volátil, fazendo com que ele diminua a capacidade de evaporação do solvente. Quanto maior o número de mols de um soluto na solução, menor será a pressão máxima de vapor.
A tonoscopia pode ser calculada por meio da fórmula: Δp = p0 – p, em que:
- Δp é o abaixamento absoluto da pressão máxima de vapor da solução;
- p0 é a pressão máxima de vapor do líquido puro, à temperatura t;
- p é a pressão máxima de vapor da solução, também à temperatura t.
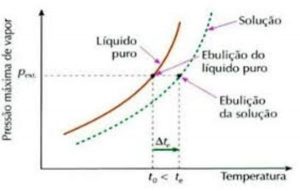
- Ebulioscopia ou ebuliometria (aumento ou elevação da temperatura de ebulição do solvente):
Efeito que acontece quando há a adição de um soluto no solvente, aumentando assim sua temperatura de ebulição, que dependerá da quantidade desse soluto.
O cálculo pode ser feito pela fórmula Δte = te – t0, em que:
- Δteé a elevação da temperatura de ebulição da solução;
- teé a temperatura inicial de ebulição da solução;
- t0 é a temperatura de ebulição do líquido puro.
- Crioscopia ou criometria (abaixamento ou diminuição da temperatura de congelamento do solvente):
Ocorre com a adição de um soluto no solvente, também dependendo da quantidade de soluto para ter essa diminuição da temperatura de congelamento.
O cálculo é feito por meio da expressão Δtc = t0 – tc, em que: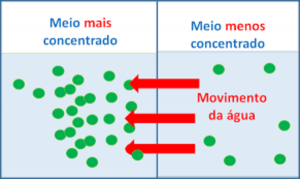
- Δtc é o abaixamento da temperatura de congelamento da solução;
- t0 é a temperatura de congelamento do solvente puro;
- tc é a temperatura inicial de congelamento do solvente na solução.
- Osmoscopia ou osmometria (pressão osmótica):
Osmose é um processo físico-químico no qual a passagem de água é feita de um meio menos concentrado (chamado de hipotônico) para um outro meio mais concentrado (conhecido como hipertônico).
Isso se dá por uma membrana semipermeável que apenas permite a passagem de água. Sendo assim, a pressão osmótica é aquela pressão que permite a movimentação da água, na qual a solução sofre pressão e impede sua diluição pela passagem do solvente puro por aquela membrana semipermeável.









Deixe seu comentário