Ligação Covalente Polar e Apolar – Qual a diferença?
Em uma ligação covalente, os elétrons são compartilhados entre os átomos envolvidos na ligação. Saiba diferenciar uma ligação Polar e Apolar
Em uma ligação covalente, os elétrons são compartilhados entre os átomos envolvidos na ligação.
Cada átomo envolvido em uma ligação covalente adquire a configuração eletrônica de valência do gás nobre mais próximo a si na tabela periódica, ou seja, com octeto completo, através do compartilhamento de elétrons.
As ligações covalentes podem ainda ser classificadas como polares ou apolares.
O que é Ligação Covalente Apolar?
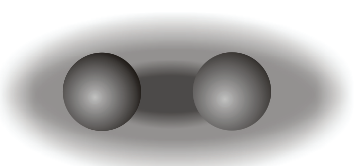
Nuvem eletrônica da ligação covalente apolar.
Nas ligações covalentes apolares, os elétrons são compartilhados igualmente entre os dois átomos envolvidos na ligação. Isso ocorre quando os átomos da ligação têm a mesma eletronegatividade, e, assim, nenhum dos núcleos atômicos terá maior força de atração sobre os elétrons.
Exemplo de moléculas apolares:
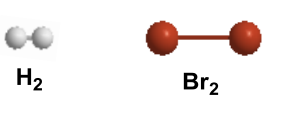
Exemplos de moléculas apolares.
O que é Ligação Covalente Polar?
As ligações covalentes polares levam em consideração o conceito de eletronegatividade, o qual indica a tendência que um átomo tem de atrair o par de elétrons da ligação para mais próximo de si.
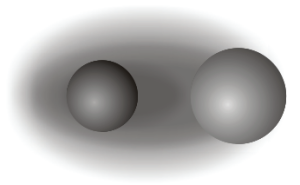
Nuvem eletrônica numa ligação covalente polar.
Uma ligação covalente é chamada de polar quando o compartilhamento do par de elétrons é realizado por átomos de eletronegatividades diferentes.
Essa diferença de força de atração dos núcleos dos átomos da ligação faz com que a nuvem eletrônica seja deslocada para mais próximo do átomo mais eletronegativo, causando na molécula o que chamamos de “dipolo elétrico”, pois haverá dois polos elétricos na ligação.
Exemplos de moléculas polares:
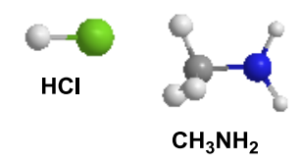
Exemplos de moléculas polares.
Qual a diferença no fim das contas?
Uma ligação covalente entre elementos de diferentes eletronegatividades acarretará na molécula uma carga parcialmente negativa próxima ao átomo do elemento mais eletronegativo e uma carga parcialmente positiva próxima ao átomo do elemento menos eletronegativo.
Em toda ligação covalente polar existirá, então, um vetor de polarização eletrônica, que indicará a orientação da carga parcialmente positiva e da carga parcialmente negativa na ligação.
Essa orientação pode ser feita através de uma seta indicando para onde a nuvem eletrônica está sendo deslocada, e um sinal positivo na ponta em que estiver a carga parcial positiva, como demonstrado no exemplo abaixo:
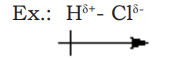
Vetor polarização da molécula de HCl.
Ainda pode ser representado apenas pelo símbolo de carga parcial em cima dos elementos, conforme exemplo abaixo:
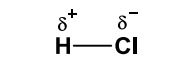
Carga parcial da molécula de HCl.
Dentre as ligações covalentes, ainda temos a ligação covalente dativa, em que o par de elétrons compartilhado é totalmente doado por um dos átomos da ligação.
Você também pode gostar de ler:
Ligação Covalente – O que é? Características, Composição e Exercícios
Referências
SILVEIRA, A. J. Química Orgânica: Teórica. 1ª ed. Belém, EditaEdi Assessoria de Educação à Distância, UFPA, 2014.
COSTA, S. M. O. MENEZES, J. E. S. A. Química Orgânica I. 2ª ed. Fortaleza, EdUECE, 2015.









Deixe seu comentário