Tabela Periódica Completa Atualizada – Elementos. Como funciona?
A tabela periódica é o documento atualizado, que organiza todos os elementos químicos conhecidos e suas propriedades. Ela coloca-os em ordem crescente ao número de prótons, sendo composta por 118 elementos químicos: 32 deles naturais e 26 artificiais. A última vez que ela foi atualizada foi em março de 2018, com o descobrimento do Oganesson (Og), elemento sintético e de maior número atômico da tabela.
Este tipo de organização é adotado mundialmente na Química, desde 1869, quando o cientista siberiano, Dimitri Mandeleev, propôs a tabela periódica, para organização dos elementos químicos, sendo que, na época, eram conhecidos somente 60. A primeira forma é mantida até hoje: são identificados conforme massa, átomos, propriedade e categoria pertencente.
Tabela Periódica Atualizada Completa (2018)
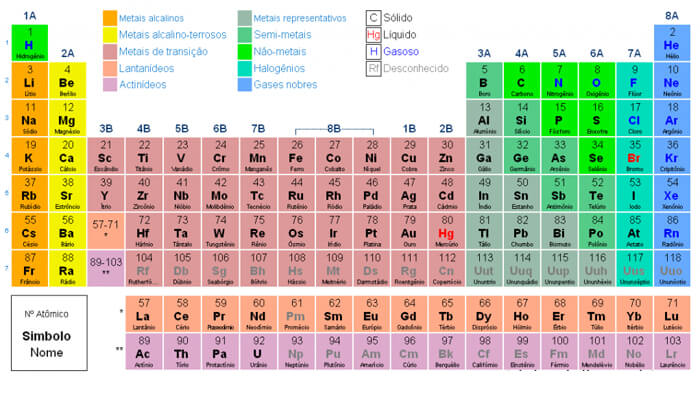
Acima, você confere a tabela atualizada e completa, sendo que a última atualização foi com o Rutênio, em 2018. A descoberta foi feita por cientistas japoneses, liderados pelo físico Hideto Enyo, que comandava o acelerador de partículas de Tóquio.
O novo elemento inaugurou uma nova linha (a oitava) na tabela periódica, tendo surgido a partir de feixes de vanádio, um metal com alvo de cúrio – um dos elementos mais pesados encontrados na Terra. A teoria é que o núcleo do átomo possui 23 prótons do cúrio 96. Juntos, eles criam um elemento de 119 prótons. O elemento eletromagnético pode contribuir para várias funções na sociedade, inclusive na melhoria de aparatos tecnológicos da indústria de eletrônicos e automobilística.
Como funciona a tabela
Ela é organizada com várias informações, cada uma ajudando no processo de identificação dos elementos. Confira como lê-la corretamente:
Período
As linhas horizontais são os períodos (correspondem as linhas). Eles são separados em um total de 7:
- 1º período: 2 elementos;
- 2º período: 8 elementos;
- 3° período: 8 elementos;
- 4° período: 18 elementos;
- 5° período: 18 elementos;
- 6° período: 32 elementos;
- 7° período : 32 elementos.
Famílias e Grupos
As famílias são as linhas verticais. Nessa posição são informados os números de elétrons e a camada de valência, representada com números. Enquanto isso, os grupos são as letras que o acompanham e servem para identificar o tipo de material.
- Família 1A: Metais Alcalinos (lítio, sódio, potássion, rubídio, césio e frâncio);
- Família 2A: Metais Alcalino- Terrosos (berílio, magnésio, cálcio, estrôncio, bário e rádio);
- Família 3A: Família do Boro (boro, alumínio, gálio, índio, tálio e unúntrio);
- Família 4A: Família do Carbono (carbono, silício, germânio, estanho, chumbo e fleróvio);
- Família 5A: Família do Nitrogênio (nitrogênio, fósforo, arsênio,antimônio,busmuto e ununpêntio);
- Família 6A: Calcogênios (oxigênio, enxofre, sel~enio,telúrio,polônio,livermório);
- Família 7A: Halogênios (flúor, cloro, bromo, iodo, astato e ununséptio);
- Família 8A: Gases Nobres (hélio, neônio, argônio,criptônio,xenônio,radônio e ununóctio).
Já os pertencentes à família com grupo B são os metais de transição, que pode ser interna ou externa. Os representativos são aqueles que terminam em s ou p, já os de transição externa terminam em d ou f.
- Família 1B: cobre, prata, ouro e roentgênio;
- Família 2B: zinco, cádmio, mercúrio e copernício;
- Família 3B: escândio, ítrio e sério de lantanídeos (15 elementos) e actinídeos (15 elementos);
- Família 4B: titânio, zircônio, háfnio e rutherfórdio;
- Família 5B: vanádio, nióbio, tântalo e dúbnio;
- Família 6B: cromo, molibdênio, tungstênio e seabórgio;
- Família 7B: manganês, tecnécio, rênio e bóhrio;
- Família 8B: ferro, rutênio, ósmio, hássio, cobalto, ródio, irídio, meitnério, níquel, paládio, platina, darmstádio.
Classificação dos elementos
Os elementos são classificados conforme o tipo, separados em:
- Metais: têm como característica conduzir o calor e a eletricidade. São sólidos (com exceção do mercúrio) e com boa maleabilidade;
- Não metais: têm como característica conduzir bem correntes elétricas e calor. No entanto, diferentemente dos metais, não têm uma forma física única: assumem qualquer estado físico, de acordo com a temperatura do ambiente que se encontram;
- Semi-metais: têm propriedades intermediárias, sendo todos sólidos, quando encontrados em temperatura ambiente. Têm características tanto de metais como de não-metais;
- Gases Nobres: são considerados inertes e têm baixa reatividade, dificilmente conduzindo eletricidade ou calor.
Elementos naturais e artificiais
A tabela difere os elementos naturais, ou seja, aquele naturalmente existentes na Terra, dos fabricados em laboratórios, por meio de pesquisas nucleares. O primeiro elemento sintético descoberto foi o tecnécio (número atômico 43).
Outros exemplos de elementos químicos descobertos por experimentações são frâncio, plutônio e urânio. As principais características destes elementos é que a grande maioria deles é radioativa, tendo uma vida média muito pequena – rapidamente deixam de existir. Além disso, alguns não ficam no ambiente mais do que alguns segundos.
Informações dos elementos
Dentro das caixas de cada elemento também organizam-se informações sobre aquele elemento em si. Ao lado superior esquerdo fica o número atômico (quantidade de átomos); no inferior esquerdo estão massa e nome por extenso; ao centro fica o símbolo; e no lado superior direito está a distribuição eletrônica.
No exemplo abaixo, você percebe como são distribuídas as informações do elemento Ferro (Fe):
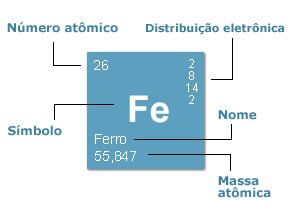
Este documento é utilizado para praticamente todos os estudos químicos, já que facilita – e muito – as operações, a distribuição e a organização dos elementos já mapeados.
História da Tabela Periódica
O modelo de tabela que conhecemos hoje foi proposto em 1869 pelo russo Dmitri Mendeleiev. A finalidade da tabela periódica era para facilitar a classificação, organização e o agrupamento dos elementos químicos de acordo com as suas propriedades.
O primeiro elemento a ser descoberto foi o fósforo – revelado ao mundo em 1669.
Para você entender – FAQ resumo sobre “Tabela Periódica”
Entenda mais sobre Tabela Periódica! Essas perguntas são as mais comuns entre as pessoas que buscam entender mais sobre esse assunto.
Quantos elementos têm na tabela periódica completa?
A versão mais completa e recente da tabela que é utilizada pela União Internacional da Química Pura e Aplicada (IUPAC), é composta por 118 elementos químicos.
Como a tabela periódica é organizada?
A tabela periódica é organizada em 7 linhas horizontais – que são os períodos, e 18 linhas verticais – grupos e famílias, quando eles pertencem a mesma família, isso quer dizer que possuem propriedades físicas e químicas semelhantes. Elas são organizadas de acordo com suas propriedades e informações.








2 comentários
ESSE TEXTO TEM QUE SER URGENTEMENTE REVISADO!!!
O início está muito equivocado.
Hoje tem apenas 118 elementos, e não 119.
O que foi adicionado em 2018 foi o Oganesson (Og), e não o Rutênio (Ru).
É necessário que os artigos em áreas específicas sejam feitos por quem entende do assunto, para não ofender a quem entende, como é o caso desde.
Oi, Adauto. Todos nossos textos são escritos ou revisados por professores, com formação na respectiva área do conhecimento. Isso não impede eventuais equívocos. Agradecemos a observação e já fizemos a alteração no texto. Qualquer outra questão, pode avisar!