Modelo Atômico de Thomson – O que é? Características e Exercícios
Os modelos atômicos surgiram da necessidade de entendermos qual é e como se constitui a matéria ao nosso redor. Os primeiros escritos sobre este assunto datam do século V antes de Cristo, na Grécia, feitos por pensadores e cientistas da época. Naquele momento, a estrutura da matéria foi denominada átomo, que significa indivisível, na língua grega.
Com o passar do tempo, cientistas foram realizando experimentos cada vez mais elaborados para melhorar a descrição da estrutura do átomo. Atualmente, o modelo que utilizamos é o desenvolvido por Rutherford, mas implementado por Bohr, sendo assim chamado modelo de Rutherford-Bohr. No entanto, trataremos com mais detalhes, neste artigo, a respeito do modelo proposto por Joseph John Thomson, igualmente importante.
O que é o modelo atômico de Thomson?
O físico inglês Thomson se propôs a estudar como seria a estrutura atômica. Seus experimentos eram realizados com descargas elétricas em gases. Após uma série deles, em 1898, concluiu que qualquer matéria possuía massa muito menor do que o átomo de Hidrogênio, e que, tais partículas de massa  possuíam carga negativa e podiam ser transferidas de um átomo a outro.
possuíam carga negativa e podiam ser transferidas de um átomo a outro.
Apesar de Dalton ter desenvolvido o primeiro modelo atômico, foi Thomson que notou a divisibilidade do átomo, apresentando as primeiras ideias quanto à estrutura interna. Assim, sua maior contribuição para o modelo de Rutherford-Bohr, que usamos hoje em dia, foi a descoberta dos corpúsculos de carga negativa, chamados de elétrons. Thomson ficou então conhecido como “pai do elétron”.
Como funciona?
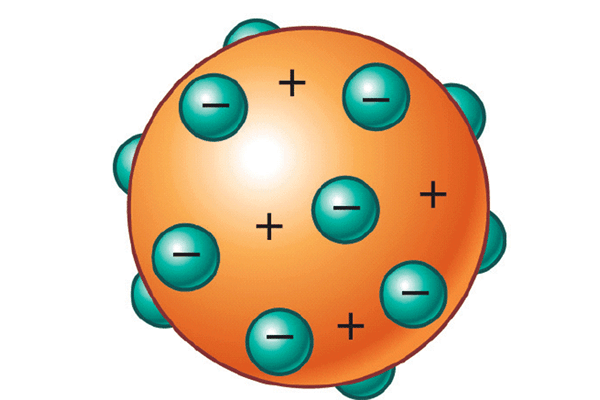
O modelo deste pesquisador ficou conhecido como “pudim de passas” ou “pudim de ameixas”, pois a estrutura proposta lembrava o doce que a mãe dele preparava na época.
Ou seja, com a descoberta dos elétrons, o estudioso produziu um modelo no qual o átomo seria uma esfera de carga positiva, não maciça, contendo os corpúsculos de carga negativa (elétrons) e que estariam distribuídos uniformemente na esfera, garantindo, assim, o equilíbrio elétrico entre as cargas positivas e negativas, resultando em carga elétrica total nula.

Agora que você já sabe um pouco mais a respeito do Modelo Atômico de Thomson, que tal testar os seus conhecimentos nos exercícios que preparamos para você? Basta rolar até o final da página e se divertir! Ah, e não deixe de compartilhar com os seus amigos, desafiando eles também.








Deixe seu comentário