Teoria do Octeto – Definição, exemplos e exceções
Entenda o que é a Teoria do Octeto, qual sua relação com a Camada de Valência e veja uma lista de exceções e exemplos!
Geralmente, os átomos ganham, perdem ou compartilham elétrons a fim de se obter o mesmo número de elétrons de valência do gás nobre mais próximo na tabela periódica. Com exceção do hélio (He), todos os gases nobres apresentam 8 elétrons na camada de valência (camada mais distante do núcleo).
Isso ocorre pois os gases nobres são elementos de configuração eletrônica muito estável, como pode ser comprovado pelas suas altas energias de ionização, baixa afinidade eletrônica e baixa reatividade química.
Os átomos, então, tendem a se ligarem entre si buscando formar uma camada de valência contendo 8 elétrons. Essa observação foi denominada como regra do octeto, uma importante diretriz para orientar à construção de fórmulas estruturais e para introduzir conceitos sobre ligações químicas.
Representação
Seguindo a orientação dos símbolos de Lewis, o octeto de valência é representado por quatro pares de elétrons circundando o símbolo do elemento químico, como mostrado no exemplo do neônio (Ne):

Nas ligações químicas covalentes, os pares de elétrons compartilhados entre os átomos é representado por um traço, e os pares de elétrons livres são representados por pontos em pares circundando o elemento, conforme o exemplo abaixo:
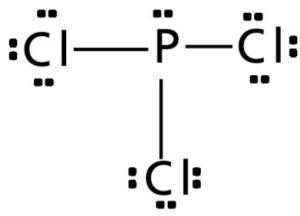
Exceções à regra do octeto
A maioria dos compostos químicos, sejam eles covalentes ou iônicos, segue a regra do octeto, porém existem algumas exceções, que são divididas em três classes:
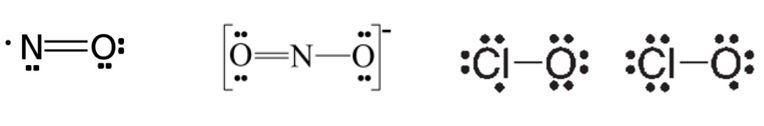
1. Moléculas que possuem número ímpar de elétrons (radicais livres). Exemplos: NO, NO2 e ClO2.
2. Moléculas com deficiência de elétron, um dos átomos constituintes tem menos de 8 elétrons na camada de valência, formadas geralmente por elementos do grupo (linha vertical) 1A, 2A e 3A da tabela periódica. Exemplos: BF3 e BeF2.
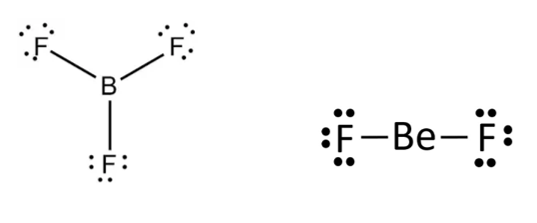
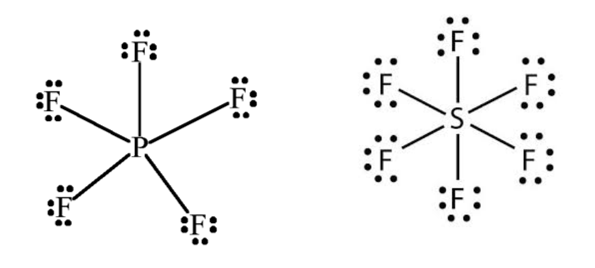
3. Moléculas que comportam mais que 8 elétrons na camada de valência extrapolam a regra do octeto. Essa exceção ocorre com os átomos do 3º período (linha horizontal) da tabela periódica em diante, pois esses átomos possuem orbitais d disponíveis para receberem elétrons extras. Exemplos: PF5 e SF6.
Referências
BROWN, T. LEMAY, E. BURSTEN, B. MURPHY, C. et al. Química: a ciência central. 13ª ed. São Paulo: Pearson Education do Brasil, 2016.
Estrutura de Lewis do tricloreto de fósforo, PCl3. Canal CECIERJ, 2011. Disponível em: https://canal.cecierj.edu.br/recurso/8165 Acesso em: 14 nov 2022.






Deixe seu comentário