Forças Intermoleculares – O que são? Composição e Características
Como a água evapora quando atinge certa temperatura? Como as plantas conseguem conduzir os nutrientes da raiz até suas folhas? Por que a gota de chuva tem esse formato? Essas questões são respondidas pelo estudo das forças intermoleculares.
Elas são mais fracas do que as ligações químicas (intramoleculares), mas são fortes o suficiente para serem responsáveis pelas diferentes propriedades físicas dessas moléculas. Sem elas, todas as substâncias seriam gases, por exemplo.
Mas, antes de explicarmos como as forças agem e o que são, precisamos definir alguns conceitos químicos:
- Íon: átomo com deficiência ou excesso de elétrons;
- Eletronegatividade: tendência do átomo a receber mais elétrons, formando um íon negativo;
- Dipolo: polos diferentes em uma molécula (positivo e negativo);
- Molécula polar: moléculas que apresentam polo negativo e positivo;
- Molécula apolar: não apresentam polos, pois seus vetores se anulam.

O que são forças intermoleculares?
Os campos magnéticos que existem nas moléculas interagem quando elas se aproximam umas das outras. Essa força de aproximação é chamada de força intermolecular, e depende:
- Do tipo da molécula (polar ou apolar);
- Da intensidade da polaridade.
Características
Forças intermoleculares são:
- Mais fracas que ligações iônicas covalentes;
- Quanto mais forte a atração, maior a temperatura na qual o líquido entrará em ebulição;
- Quanto maior a força intermolecular, maior o ponto de fusão (processo pelo qual uma substância passa do estado sólido para o líquido).
Tipos
Existem quatro tipos de forças intermoleculares, também chamadas de Forças de van der Waals. Confira, abaixo, as características de cada uma delas:
- Dispersão de London (ou dipolo induzido):
- Ocorre entre moléculas apolar x molécula apolar, quando estão próximas;
- Uma das moléculas polares induz um dipolo temporário na molécula vizinha. Ou seja, ocorre a polarização induzida, resultando em uma atração entre molécula apolar x molécula polar;
- Atração.
- Dipolo-dipolo (ou dipolo permanente):
- Ocorre entre molécula polar x molécula polar
- A atração acontece quando o lado positivo de uma molécula está perto do polo negativo de outra molécula;
- Influenciam a evaporação e o ponto de ebulição de um líquido;
- Afetam a solubilidade.
- Ligação de hidrogênio:
- Ocorre entre átomo de hidrogênio (H) x flúor (F), oxigênio (O) ou nitrogênio (N) (átomos com forte eletronegatividade);
- São moléculas que apresentam polaridade muito intensas;
- Ligações polares muito fortes (mais fortes do que as forças dipolo-dipolo e dispersão de London);
- Quanto maior a massa molecular, maior o ponto de ebulição;
- Geralmente, possuem pontos de ebulição elevados.
- Íon-dipolo:
- Ocorre entre íon x uma molécula polar;
- Atração mais forte de todas.
Em resumo, podemos dizer, então, que as ligações, da mais fraca para a mais forte, são: dispersão de London → dipolo-dipolo → ligação de hidrogênio → íon-dipolo.
Importância
As forças intermoleculares são responsáveis por vários fenômenos presentes no nosso cotidiano, como a capilaridade, a tensão superficial e as mudanças de estado físico das moléculas.
Exemplos
Como exemplo de substâncias que apresentam forças do tipo dipolo induzido, podemos citar o gelo seco, que é o CO2 sólido. Por outro lado, o gás clorídrico HCl é ligado por forças do tipo dipolo permanente, sendo mais forte.
Já para moléculas ligadas por pontes de hidrogênio, a água é o exemplo mais clássico, apresentando alto ponto de ebulição, alto calor específico e de vaporização.
Exercícios resolvidos
1. (ITA-SP) Sobre a temperatura de ebulição de um líquido, são feitas as seguintes afirmações:
I. Aumenta com o aumento da força da ligação química intramolecular.
II. Aumenta com o aumento da força da ligação química intermolecular.
III. Aumenta com o aumento da pressão exercida sobre o líquido.
IV. Aumenta com o aumento da quantidade de sólido dissolvido.
Estão corretas:
a) Apenas I e II.
b) Apenas I e IV.
c) Apenas III e IV.
d) Apenas II, III e IV.
e) Todas.
Alternativa “d”. A afirmação I está incorreta pois a temperatura de ebulição é influenciada pelas forças intermoleculares.
2. (Unificado-RJ) Observe a tabela de pontos de ebulição:
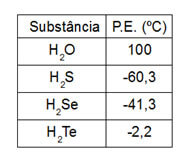
O ponto de ebulição da água é anômalo em relação aos demais compostos da família do oxigênio, porque:
a) as moléculas da água são mais leves.
b) existem pontes de hidrogênio entre as moléculas da água.
c) existem Forças de Van der Waals entre as moléculas da água.
d) somente a molécula da água é apolar.
e) as demais substâncias se decompõem termicamente.
Alternativa “b”. Apesar de todas as moléculas serem polares, a água apresenta forças intermoleculares muito intensas, chamadas de ligações de hidrogênio.






Deixe seu comentário