Modelo atômico de Bohr – O que é? Características, Composição e Exercícios
Na antiguidade, o átomo era entendido como partícula material indivisível, um conceito que foi modificado após trabalhos de inúmeros cientistas. Inclusive, muitos deles buscaram entender a configuração do átomo.
Quando se trata de em modelo atômico, pensa-se em como os átomos funcionam, quais relações estabelecem entre si, do que são compostos, e muito mais. A seguir, conheça o modelo atômico de Bohr, só aqui no Gestão Educacional!
[VEJA TAMBÉM: ESTRUTURA ATÔMICA]
O que é o modelo atômico de Bohr?
A descrição dos modelos atômicos foi realizada por diversos cientistas, sendo que cada um deles contribuiu de forma positiva e sucessiva para o entendimento completo do átomo.
Primeiramente, o estudo foi investigado por Dalton, seguido de Thomson, e, posteriormente, de Rutherford. Este último chegou a conclusões semelhantes às de Bohr, que apenas aperfeiçoou suas ideias, as quais são até hoje utilizadas.
Portanto, o modelo de Bohr mescla ideias utilizadas anteriormente com a física quântica, conseguindo explicar, quase que na complexidade, o comportamento dos átomos.
Para explicar seu modelo, Bohr utilizou o átomo de hidrogênio como exemplo. Mas, sabe-se que seus princípios são válidos também para os demais elementos.
[LEIA TAMBÉM: NÚMEROS ATÔMICOS – COMO SABER?]
Como funciona a teoria de Bohr?
Para entender o que Bohr postulou, é interessante retomar os achados de Rutherford. Este último propôs que:
- O átomo contém um núcleo positivo pequeno, e, ao seu redor, existe uma órbita com cargas negativas dispersas;
- Quase toda a massa do átomo está concentrada no núcleo.
Este modelo substituiu as ideias de Thomson, e foi sucedido por Bohr.
Bohr acreditava que os elétrons existentes ao redor do núcleo possuíam energia, o que era determinado pela distância que estes estavam do centro, e em quais das órbitas estavam inseridos.
Para passar de uma órbita para a outra, seria necessário:
- Perder energia: quando a nova órbita tivesse menor energia;
- Ganhar energia: quando a nova órbita fosse de maior energia.
Isso também explicaria o porquê de os átomos manterem-se constantemente em uma mesma órbita, pois sempre tendem a permanecer no mesmo nível de energia.
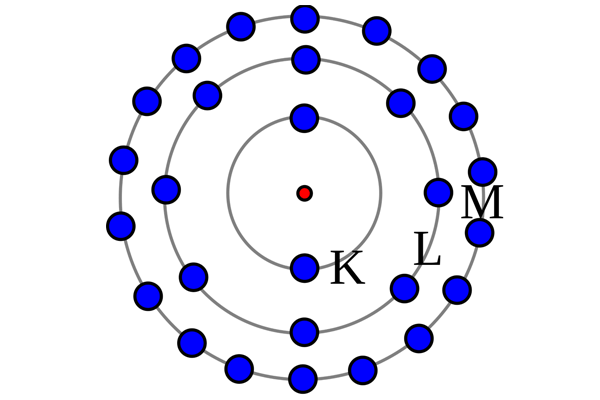
Camadas de energia
Para melhor entender como funcionariam os “níveis de energia”, Bohr estipulou camadas nas quais os átomos estariam inseridos. Elas são K, L, M, N, O, P, Q.
Os elétrons se distribuiriam, portanto, conforme os limites de cada uma destas camadas. A esse conjunto de ideias, dá-se o nome de configuração eletrônica do átomo.
Gostou? Então, veja, também, o conteúdo completo sobre Modelo atômico de Dalton – O que é? Características, Composição e Exercícios!
Agora que você já sabe um pouco mais a respeito do modelo atômico de Bohr, que tal testar os seus conhecimentos nos exercícios que preparamos para você? Basta rolar até o final da página e se divertir! Ah, e não deixe de compartilhar com os seus amigos, desafiando eles também.








Deixe seu comentário