Modelo Atômico de Rutherford – O que é? Características e Exercícios
A composição da matéria é um assunto que intriga pensadores, filósofos e cientistas desde o século V antes de Cristo, data em que se tem registro de escritos sobre o assunto, na Grécia. Na época, deram o nome da estrutura da matéria de átomo, que, em grego, significa indivisível.
Os modelos atômicos, surgiram na tentativa de explicar como seria a estrutura e composição do átomo. A partir dos experimentos feitos por cientistas, descobriu-se que o átomo não é indivisível como pensavam, mas o nome prevaleceu.
O primeiro modelo atômico foi apresentado em 1808, por John Dalton, seguido por Thomson, e depois Rutherford, em 1911. E é sobre esse último modelo que detalharemos no artigo de hoje.
O que é o modelo atômico de Rutherford?
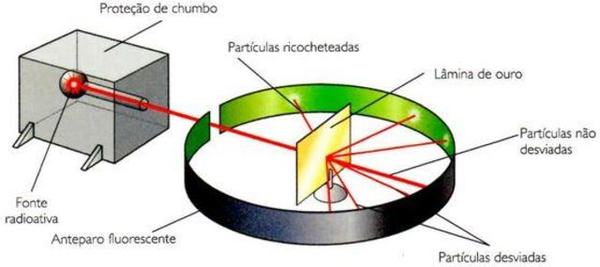
Não satisfeito com os modelos sugeridos por Dalton e Thomson, Rutherford seguiu realizando experimentos sobre a estrutura atômica. No início do século XX, ele bombardeou uma lâmina de ouro muito fina, encoberta por zinco, com partículas α (alfa) emitidas pelo elemento químico Polônio.
O resultado foi que uma pequena quantidade de partículas não atravessava a lâmina, enquanto a maioria atravessava e apenas algumas sofriam desvio de rota. Assim, ele hipotetizou que a massa da lâmina de ouro estaria distribuída em pequenos pontos, mas que o tamanho do átomo deveria ser muito maior do que o núcleo, havendo espaços vazios, por onde a maioria das partículas atravessou. As que não atravessaram, teriam, hipoteticamente, colidido com os núcleos.
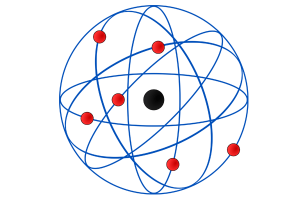
O modelo proposto por ele, então, foi de que o átomo seria composto por um núcleo pequeno com carga positiva e uma região ao redor dele, chamada de eletrosfera, de carga negativa, onde os elétrons ficariam em órbita. Em resumo, ele descobriu que o átomo não é uma esfera maciça, como sugerido por Dalton.
Como funciona
O modelo atômico de Rutherford ficou conhecido como modelo planetário:
- O núcleo é representado pelo Sol, na região central do átomo, e suas características são: carga positiva (prótons), baixo volume, maior massa e densidade;
- Os elétrons são representados pelos planetas em órbita ao redor do núcleo. As características são: carga negativa (elétrons) e imensos espaços vazios entre eles.
Agora que você já sabe um pouco mais a respeito do Modelo Atômico de Rutherford, que tal testar os seus conhecimentos nos exercícios que preparamos para você? Basta rolar até o final da página e se divertir! Ah, e não deixe de compartilhar com os seus amigos, desafiando eles também.









Deixe seu comentário